Table of Contents
परमाणु संरचना का अध्ययन भौतिक विज्ञान और रसायन विज्ञान के मूलभूत विषयों में से एक है। परमाणु, जो किसी भी पदार्थ का सबसे छोटा इकाई होता है, कई छोटे कणों से मिलकर बना होता है। इन कणों में मुख्य रूप से प्रोटॉन, न्यूट्रॉन, और इलेक्ट्रॉन शामिल होते हैं। परमाणु की यह संरचना न केवल उसकी भौतिक और रासायनिक गुणधर्मों को निर्धारित करती है, बल्कि यह भी बताती है कि तत्वों की विभिन्न प्रकार की प्रतिक्रिया कैसे होती है। इस लेख में, हम परमाणु संरचना के विभिन्न पहलुओं, इसके घटकों और उनके आपसी संबंधों पर विस्तृत रूप से चर्चा करेंगे।
परमाणु की संरचना क्या है?
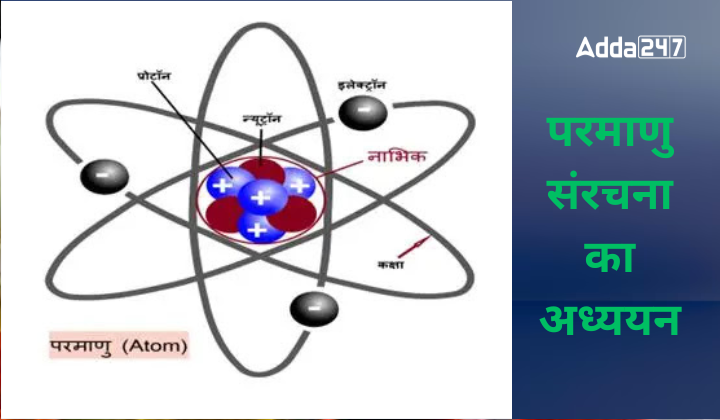
परमाणु संरचना एक परमाणु की संरचना को संदर्भित करती है जिसमें एक नाभिक (केंद्र) होता है जिसमें प्रोटॉन (धनात्मक आवेशित) और न्यूट्रॉन (उदासीन कण) मौजूद होते हैं। इलेक्ट्रॉन नामक ऋणात्मक आवेशित कण नाभिक के केंद्र के चारों ओर घूमते हैं। परमाणु संरचना और क्वांटम यांत्रिकी का इतिहास डेमोक्रिटस के समय का है, जिसने सबसे पहले यह प्रस्तावित किया था कि पदार्थ परमाणुओं से बना है। 1800 के दशक में जॉन डाल्टन द्वारा परमाणु संरचना का पहला वैज्ञानिक सिद्धांत प्रस्तावित किया गया था।
परमाणु
परमाणु किसी भी पदार्थ की सबसे छोटी इकाई है, जो रासायनिक गुणधर्मों को बनाए रखते हुए, विभिन्न तत्वों को बनाता है। यह एक जटिल संरचना है, जिसमें केंद्र में एक नाभिक (न्यूक्लियस) होता है और इसके चारों ओर इलेक्ट्रॉन घूर्णन करते हैं। नाभिक में प्रोटॉन और न्यूट्रॉन शामिल होते हैं, जबकि इलेक्ट्रॉन नाभिक के चारों ओर इलेक्ट्रॉनिक कोशों में उपस्थित रहते हैं।
प्रोटॉन धनावेशित होते हैं, न्यूट्रॉन का कोई आवेश नहीं होता है, और इलेक्ट्रॉन ऋणावेशित होते हैं। इन कणों के आपसी आकर्षण और प्रतिकर्षण बलों के कारण परमाणु स्थिर रहता है। विभिन्न तत्वों के परमाणुओं में प्रोटॉन, न्यूट्रॉन और इलेक्ट्रॉन की संख्या भिन्न-भिन्न होती है, जो उन्हें उनके विशिष्ट गुणधर्म प्रदान करती है।
परमाणु की संरचना को समझने के लिए कई मॉडल प्रस्तावित किए गए हैं, जिनमें डॉल्टन का परमाणु सिद्धांत, थॉमसन का पुडिंग मॉडल, रदरफोर्ड का परमाणु मॉडल और बोहर का मॉडल प्रमुख हैं। आधुनिक परमाणु सिद्धांत क्वांटम यांत्रिकी पर आधारित है, जो इलेक्ट्रॉन के संभाव्यता वितरण को ध्यान में रखते हुए परमाणु की संरचना को समझाने का प्रयास करता है।
परमाणु संरचना का अध्ययन
एक परमाणु में तीन मूल कण प्रोटॉन, न्यूट्रॉन और इलेक्ट्रॉन हैं। परमाणु के नाभिक में प्रोटॉन और न्यूट्रॉन होते हैं जहां प्रोटॉन धनात्मक रूप से आवेशित होते हैं और न्यूट्रॉन उदासीन होते हैं। इलेक्ट्रॉन उन सबसे बाहरी क्षेत्रों में स्थित होते हैं जिन्हें इलेक्ट्रॉन कोश कहा जाता है।
नाभिक
परमाणु के बीच में उपस्थित धनात्मक वैद्युत आवेश युक्त एक ठोस भाग उपस्थित है। नाभिक की खोज अर्नेस्ट रदरफोर्ड ने 1911 में की थी। कुछ नाभिक गोल आकृति के होते है जबकि कुछ की आकृति थोडी दबी हुई तथा विकृत होती है। नाभिक, नाभिकीय कणों प्रोटॉन तथा न्यूट्रॉन से बने होते है। इस कण को नूक्लियान्स कहा जाता है। नाभिक का व्यास (10−15 मीटर) (हाइड्रोजन-नाभिक) से (10−14 मीटर) (यूरेनियम) की सीमा में होता है। परमाणु का लगभग सारा द्रव्यमान नाभिक के कारण ही होता है, इलेक्ट्रान का योगदान लगभग नगण्य होता है।
इलेक्ट्रॉन
जे जे थॉमसन ने 1897 में एक कैथोड किरण प्रयोग में कैथोड द्वारा एनोड की ओर उत्सर्जित होने वाले ऋणात्मक आवेशित कणों की खोज की। ये ऋणावेशित कण इलेक्ट्रॉन हैं। इलेक्ट्रॉन को से e दर्शाते हैं। इलेक्ट्रॉन या विद्युदणु ऋणात्मक वैद्युत आवेश युक्त मूलभूत उपपरमाणविक कण होता है। यह परमाणु में नाभिक के चारो तरफ घूमता रहता हैं। इसका द्रव्यमान सबसे छोटे परमाणु (हाइड्रोजन) से भी हजारगुना कम ही होता है। परम्परागत रूप से इसके आवेश को ऋणात्मक माना जाता है और इसका मान –1 परमाणु इकाई (e) निर्धारित किया गया है। इस पर -1.6E-19 कूलाम्ब परिमाण का ऋण आवेश होता है। इसका द्रव्यमान 9.11E−31 किग्रा होता है जो प्रोटॉन के द्रव्यमान का लगभग 1837 वां भाग है।
प्रोटाॅन
ई. गोल्डस्टीन ने उनके द्वारा प्रसिद्ध एनोड किरणों या केताल किरणों के प्रयोग द्वारा परमाणु मे धनावेशित कण यानी प्रोटॉन की खोज की। 1886 में अर्नेस्ट गोल्डस्टीन ने पाया कि एक ही कक्ष में एक अलग स्थिति के साथ, एनोड धनात्मक रूप से आवेशित कण उत्सर्जित करता है जिसे कैनाल किरणें या बाद में प्रोटॉन के रूप में जाना जाने लगा। प्रोटॉन एक धनात्मक विद्युत आवेशयुक्त कण है, जो परमाणु के नाभिक में न्यूट्रॉन के साथ पाया जाता हैं। इसे p प्रतिक चिह्न द्वारा प्रदर्शित किया जाता है। इस पर 1.602E−19 कूलाॅम का धनावेश होता है। इसका द्रव्यमान 1.6726E−27 किग्रा होता है जो इलेक्ट्रॉन के द्रब्यमान के लगभग 1845 गुना है।
न्यूट्रॉन
1982 में जिम्स चैडविक ने एक और अवपरमाणुक कण को खोज निकाला, जो अनावेशित और द्रव्यमान में प्रोटॉन के बराबर था। इन कणों को न्यूट्रॉन का नाम दिया गया। हाइड्रोजन को छोड़कर ये सभी परमाणुओं के नाभिक मे होते है। न्यूट्रॉन को n से दर्शाते है। न्यूट्रॉन एक उपपरमाण्विककण होता है जो प्रत्येक पदार्थों के परमाणु के नाभिक में उपस्थित होता है। प्रोटॉन और न्यूट्रॉन दोनों एक साथ होकर परमाणु के नाभिक बनाते हैं। न्यूट्रॉन एक विद्युत उदासीन कण है जिसका द्रव्यमान 1.67493 × 10−27 kg होता है, जो कि इलेक्ट्रॉन के द्रव्यमान से 1,839 गुना अधिक है।
परमाणु की संरचना को समझने के लिए प्रस्तावित माॅडल
परमाणु की संरचना को समझने के लिए विभिन्न वैज्ञानिकों ने समय-समय पर विभिन्न मॉडल प्रस्तावित किए हैं। इन मॉडलों ने परमाणु के बारे में हमारी समझ को गहराई से बढ़ाया है और हमें पदार्थ की संरचना और व्यवहार को बेहतर ढंग से समझने में मदद की है। आइए इन प्रमुख मॉडलों पर एक नजर डालें:
डॉल्टन का परमाणु सिद्धांत (1803)
जॉन डॉल्टन ने पहला परमाणु सिद्धांत प्रस्तावित किया, जिसके मुख्य बिंदु निम्नलिखित हैं:
- सभी पदार्थ अणुओं से बने होते हैं, जो अविभाज्य और अविनाशी होते हैं।
- एक ही तत्व के सभी परमाणु एक जैसे होते हैं, लेकिन विभिन्न तत्वों के परमाणु भिन्न होते हैं।
- रासायनिक प्रतिक्रियाओं के दौरान, परमाणु पुनर्व्यवस्थित होते हैं।
डाल्टन के सिद्धांत की कमियाँ:
- डाल्टन ने कहा कि एक ही तत्व के परमाणु सभी प्रकार से समान होते हैं और विभिन्न तत्वों के परमाणु सभी प्रकार से भिन्न होते हैं।
- कई अन्य वैज्ञानिकों ने पाया कि परमाणु इलेक्ट्रॉन प्रोटॉन और न्यूट्रॉन से बने होते हैं।
थॉमसन का प्लम-पुडिंग मॉडल (1897)
जे.जे. थॉमसन ने अपने कैथोड किरण प्रयोग के आधार पर यह मॉडल प्रस्तावित किया:
- परमाणु धनावेशित पदार्थ का एक गोला होता है, जिसमें ऋणावेशित इलेक्ट्रॉन समाहित होते हैं, जैसे कि प्लम पुडिंग में किशमिश।
- इस मॉडल ने इलेक्ट्रॉन की खोज को दर्शाया लेकिन नाभिक की उपस्थिति को नहीं समझा।
जे.जे. थॉमसन के परमाणु मॉडल की कमियाँ:
- यह यह समझाने में विफल रहा कि परमाणु के अंदर इलेक्ट्रॉन पर धनात्मक आवेश कैसे रहता है।
- यह परमाणु की स्थिरता के कारणों को समझाने में भी विफल रहा।
रदरफोर्ड का परमाणु मॉडल (1911)
अर्नेस्ट रदरफोर्ड ने अपने स्वर्ण पन्नी प्रयोग के आधार पर यह मॉडल प्रस्तुत किया:
- परमाणु के केंद्र में एक छोटा, घना, और धनावेशित नाभिक होता है।
- इलेक्ट्रॉन नाभिक के चारों ओर कक्षाओं में परिक्रमा करते हैं।
- इस मॉडल ने नाभिक की खोज को प्रमाणित किया लेकिन इलेक्ट्रॉन की स्थिरता को स्पष्ट नहीं किया।
रदरफोर्ड के परमाणु मॉडल की कमियाँ:
-
यह परमाणु मॉडल परमाणुओं की स्थिरता को समझाने में असफल रहा।
-
मॉडल के अनुसार, इलेक्ट्रॉन धनात्मक आवेशित नाभिक के चारों ओर चक्कर लगाते हैं। यह लंबे समय तक संभव नहीं है क्योंकि हम जानते हैं कि परमाणु स्थिर होते हैं जबकि वृत्ताकार कक्षा में कोई भी कण त्वरण से गुजरता है। त्वरण के दौरान आवेशित कण ऊर्जा विकीर्ण करेंगे। घूमते हुए इलेक्ट्रॉन ऊर्जा खो देंगे और अंततः नाभिक में गिर जाएंगे।
-
परमाणु का यह मॉडल हाइड्रोजन स्पेक्ट्रम में निश्चित रेखाओं के अस्तित्व को समझाने में भी असफल रहा।
बोहर का परमाणु मॉडल (1913)
नील्स बोहर ने रदरफोर्ड मॉडल में सुधार करते हुए यह मॉडल प्रस्तावित किया:
- बोहर ने परिमाणीकरण की अवधारणा का उपयोग किया और अपने सिद्धांत में निम्नलिखित बातें सामने रखीं।
- इलेक्ट्रॉन अपनी कक्षाओं में बिना ऊर्जा खोए घूमते रहते हैं।
- एक इलेक्ट्रॉन ऊर्जा प्राप्त करके निम्न से उच्च अवस्था की ओर बढ़ता है और ऊर्जा खोकर उच्च ऊर्जा अवस्था से निम्न ऊर्जा अवस्था की ओर बढ़ता है।
- किसी इलेक्ट्रॉन के निम्नतम ऊर्जा स्तर को जमीनी अवस्था कहा जाता है।
- ऊर्जा स्तर को एक पूर्णांक द्वारा दर्शाया जाता है जिसे क्वांटम संख्या के रूप में जाना जाता है। ये क्वांटम संख्याएँ n=1, 2, 3,….. से शुरू होती हैं और K, L, M, N,…कोशों के रूप में निर्दिष्ट की जाती हैं।
नील बोहर के सिद्धांत की कमियाँ:
- बोहर का मॉडल परमाणुओं के स्पेक्ट्रा पर चुंबकीय क्षेत्र और विद्युत क्षेत्र के प्रभाव को परिभाषित करने में सक्षम नहीं था।
- बोहर परमाणु मॉडल ने हाइड्रोजन जैसे छोटे आकार के परमाणुओं के लिए सही भविष्यवाणियां कीं, लेकिन जब बड़े परमाणुओं पर विचार किया गया तो खराब वर्णक्रमीय भविष्यवाणियां प्राप्त हुईं।
परमाणु संख्या
परमाणु के नाभिक में पाए जाने वाले प्रोटॉनों की संख्या को परमाणु संख्या कहा जाता है। इसे ‘Z’ अक्षर से प्रदर्शित किया जाता है। परमाणु संख्या के महत्वपूर्ण बिंदु-
- एक परमाणु के नाभिक में प्रोटॉन की कुल संख्या हमें उस परमाणु की परमाणु संख्या देती है।
- इसे ‘Z’ अक्षर से प्रदर्शित किया जाता है।
- किसी विशेष तत्व के सभी परमाणुओं में समान संख्या में प्रोटॉन होते हैं, और इसलिए एक ही परमाणु संख्या होती है।
- विभिन्न तत्वों के परमाणुओं की परमाणु संख्या भिन्न होती है।
- उदाहरण के लिए, सभी कार्बन परमाणुओं की परमाणु संख्या 6 होती है, जबकि ऑक्सीजन के सभी परमाणुओं के नाभिक में 8 प्रोटॉन होते हैं।
द्रव्यमान संख्या
नाभिक में प्रोटॉन और न्यूट्रॉन मौजूद होते हैं, इसलिए द्रव्यमान संख्या इन प्रोटॉन और न्यूट्रॉन का कुल योग है। द्रव्यमान संख्या से जुड़े महत्वपूर्ण बिंदु-
- प्रोटॉन और न्यूट्रॉन की संख्या मिलकर हमें एक परमाणु की द्रव्यमान संख्या देती है।
- इसे ‘A’ अक्षर से दर्शाया गया है।
- चूंकि प्रोटॉन और न्यूट्रॉन दोनों एक परमाणु के नाभिक में मौजूद होते हैं, इसलिए उन्हें एक साथ न्यूक्लियॉन कहा जाता है।
- इलेक्ट्रॉन का भार लगभग नगण्य होता है। इस प्रकार, एक परमाणु का परमाणु द्रव्यमान उसकी द्रव्यमान संख्या के लगभग समान होता है।
- उदाहरण के लिए, कार्बन के एक परमाणु में 6 प्रोटॉन और 6 न्यूट्रॉन होते हैं। अतः इसकी द्रव्यमान संख्या 12 है।
- जबकि एक तत्व के सभी परमाणुओं में प्रोटॉन की संख्या समान रहती है, न्यूट्रॉन की संख्या भिन्न हो सकती है। इस प्रकार, एक ही तत्व के परमाणुओं की भिन्न-भिन्न द्रव्यमान संख्याएँ हो सकती हैं, और इन्हें समस्थानिक कहा जाता है।
परमाणु संख्या और द्रव्यमान संख्या की गणना
परमाणु की परमाणु संख्या परमाणु के नाभिक में प्रोटॉन की संख्या या विद्युत रूप से उदासीन परमाणु में इलेक्ट्रॉनों की संख्या के बराबर होती है।
परमाणु संख्या (Z) = इलेक्ट्रॉनों की संख्या = प्रोटॉन की संख्या
उदाहरण के लिए, एक सोडियम परमाणु में 11 इलेक्ट्रॉन और 11 प्रोटॉन होते हैं। अत: Na परमाणु की परमाणु संख्या = इलेक्ट्रॉनों की संख्या = प्रोटॉनों की संख्या = 11
द्रव्यमान संख्या की गणना करने के लिए निम्नलिखित चरणों का पालन किया जा सकता है:
- प्रोटॉनों की संख्या ज्ञात करना: किसी भी तत्व का परमाणु क्रमांक (Z) प्रोटॉनों की संख्या को दर्शाता है। यह आवर्त सारणी में तत्व के स्थान से ज्ञात किया जा सकता है।
- न्यूट्रॉनों की संख्या ज्ञात करना: न्यूट्रॉनों की संख्या (N) को ज्ञात करने के लिए परमाणु के कुल नाभिकीय कणों (प्रोटॉन और न्यूट्रॉन) से प्रोटॉनों की संख्या घटाई जाती है।
- द्रव्यमान संख्या ज्ञात करना: परमाणु क्रमांक (Z) और न्यूट्रॉनों की संख्या (N) को ज्ञात करने के बाद द्रव्यमान संख्या में इन मानों को सूत्र में रखकर द्रव्यमान संख्या ज्ञात की जाती है।
द्रव्यमान संख्या (A) = परमाणु संख्या (Z) + न्यूट्रॉनों की संख्या (N)
समभारिक
समभारिक विभिन्न रासायनिक तत्वों के परमाणु (न्यूक्लाइड) होते हैं जो रासायनिक गुणों में भिन्न होते हैं लेकिन भौतिक गुण समान होते हैं। अतः हम कह सकते हैं कि समभारिक वे तत्व हैं जिनकी परमाणु संख्या भिन्न होती है लेकिन द्रव्यमान संख्या समान होती है। इनके रासायनिक गुण अलग-अलग होते हैं क्योंकि इलेक्ट्रॉनों की संख्या में अंतर होता है। इसका परमाणु द्रव्यमान समान लेकिन परमाणु संख्या भिन्न होती है। ऐसा इसलिए है क्योंकि न्यूट्रॉन की अतिरिक्त संख्या न्यूक्लियॉन की संख्या में अंतर की भरपाई करती है।
समस्थानिक
आइसोटोप वे परमाणु होते हैं जिनमें न्यूट्रॉन की संख्या भिन्न होती है और प्रोटॉन की संख्या समान होती है। परमाणु द्रव्यमान और परमाणु संख्या की उपरोक्त परिभाषा से, हम यह निष्कर्ष निकाल सकते हैं कि समस्थानिक वे तत्व हैं जिनकी परमाणु संख्या समान और द्रव्यमान संख्या भिन्न होती है।
| सभी Railway Exams Crack करे With Railway Mahapack | |
 |
500 Hrs Online Live Classes |
| 445 Test Series | |
| 438 E-Books | |
| 4897 Videos | |
| Experienced Faculties | |


 Top 30 General Science Question for RRB ...
Top 30 General Science Question for RRB ...
 Top 7 Easiest Competitive Exams In India
Top 7 Easiest Competitive Exams In India
 What are Repo and Reverse Repo Rates, Kn...
What are Repo and Reverse Repo Rates, Kn...


